胆汁酸通过直接作用、宿主信号调控及菌群代谢协同实现抑菌效果,具体机理如下:
一、直接破坏细菌结构与功能
1.细胞膜损伤
胆汁酸的两亲性(亲水头部+疏水尾部)可插入细菌细胞膜,破坏磷脂双分子层完整性,影响细胞内酸碱平衡,导致膜电位消失,导致细胞内容物泄漏和渗透压失衡。革兰氏阴性菌(如大肠杆菌)对其更敏感,因其外膜脂多糖易与胆汁酸结合。次级胆汁酸(如DCA、LCA)的疏水性高于初级胆汁酸,抗菌活性更强。体外实验显示,200μM DCA可在30min内杀死99%艰难梭菌芽孢。
2.干扰代谢与复制
胆汁酸可螯合细菌生长必需的铁、钙等金属离子,影响肠道细菌分裂、运动、基因表达及趋化功能等;同时干扰DNA复制(胆汁酸进入胞内后,通过线粒体电子传递链产生活性氧ROS,诱导DNA双链断裂)和蛋白质折叠(蛋白质错误折叠),阻碍细菌增殖。
二、激活宿主防御通路
1.提高肠道屏障功能
FXR受体:胆汁酸(如CDCA)激活肠上皮FXR,促进紧密连接蛋白(occludin、ZO-1)和抗菌肽(Reg3α/γ)表达,增强物理屏障,抑制菌群过度生长。
TGR5受体:胆汁酸激活TGR5,刺激杯状细胞分泌Muc2黏液,增强黏膜层对致病菌的隔离作用。
2.调节免疫与炎症
抑制NF-κB通路:FXR通过SHP抑制NF-κB,减少促炎因子(TNF-α、IL-6)释放。
限制NLRP3炎症小体:FXR/SHP与NLRP3直接互作,阻止IL-1β/IL-18分泌,避免过度免疫反应对肠道菌群平衡的破坏。
促进抗炎细胞分化:胆汁酸刺激TGR5,促进单核细胞向耐受性树突状细胞分化,促进M0巨噬细胞向抗炎M2表型极化。
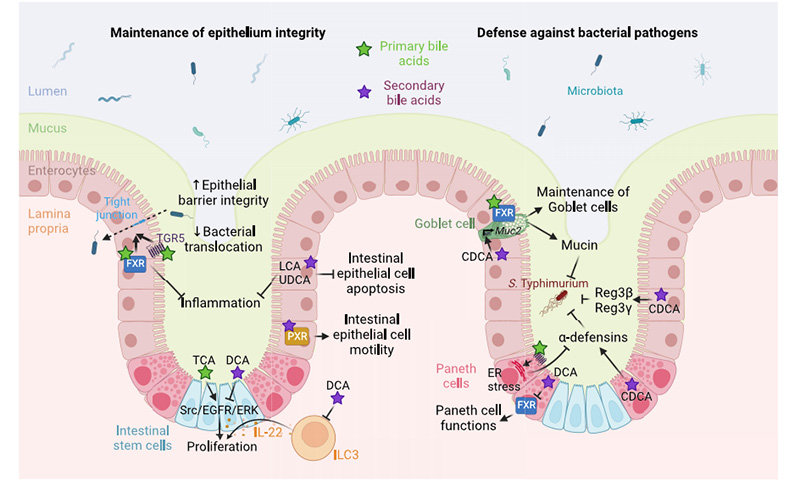
图1.胆汁酸介导的肠道屏障功能调节。胆汁酸介导的TGR5和FXR受体在肠上皮细胞中的激活增加了紧密连接蛋白的表达,从而改善上皮屏障的完整性,限制细菌移位和炎症。
三、菌群代谢协同,增强抑菌活性
1.次级胆汁酸的生成
菌群通过去结合反应(BSH酶)和脱羟基反应将初级胆汁酸转化为次级胆汁酸,增强抗菌谱。例如:
梭菌属产生的DCA可直接抑制艰难梭菌营养细胞。
双歧杆菌代谢GDCA生成DCA,抑制霍乱弧菌VI型系统(T6SS)。
2.代谢产物的抑菌协同
菌群代谢胆汁酸释放的牛磺酸可被δ-变形菌转化为硫化氢(H₂S),抑制致病菌(如肺炎克雷伯菌)的有氧呼吸,间接增强定植抗性。
四、选择性塑造菌群结构
优先保留耐胆汁酸、能代谢次级胆汁酸的共生菌,例如,给大鼠补充CA后,厚壁菌门比例从54%升至93%-98%,其中梭菌属丰度从39%增至70%。抑制敏感致病菌(如大肠杆菌、艰难梭菌),这种选择性是维持肠道稳态的核心。
五、总结
胆汁酸的抑菌作用是“直接毒性-宿主信号-菌群代谢” 多维度协同的结果:
直接作用:破坏膜结构、螯合金属离子、抑制代谢酶;
间接调控:激活FXR/TGR5通路,增强屏障功能和免疫防御;
菌群协同:依赖菌群生成高活性次级胆汁酸,通过代谢产物扩大抑菌范围。
这一机制不仅维持肠道菌群稳态,还为靶向菌群失调的治疗(如FXR激动剂、粪菌移植)提供了理论基础。
参考文献:
1、Larabi A B, Masson H L P, Bäumler A J. Bile acids as modulators of gut microbiota composition and function[J]. Gut microbes, 2023, 15(1): 2172671.
2、唐银佩,朱正望,朱平生,等.胆汁酸与肠道菌群互作在胆汁淤积发病和治疗中的作用[J].安徽医科大学学报,2025,60(03):578-583.DOI:10.19405/j.cnki.issn1000-1492.2025.03.027.