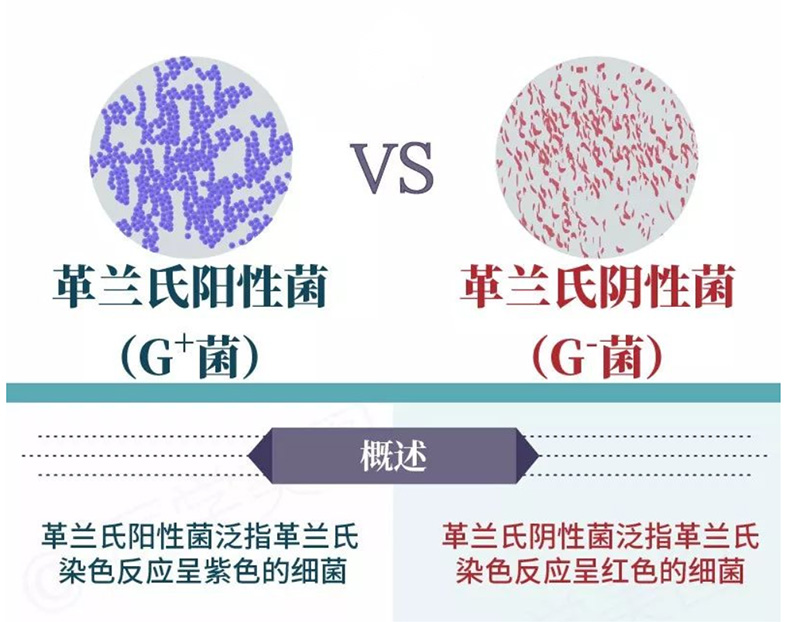
图1.革兰氏阳性菌(左)和革兰氏阴性菌(右)概述
1.肠道沙门氏菌(Salmonella enterica)
肠杆菌共同抗原(enterobacterial common antigen, ECA)是由多糖重复单元组成的多聚糖, 几乎表达于所 有肠杆菌细胞外膜. ECA合成受阻会导致大肠杆菌细胞膜完整性受损, 对酸性、低温、高盐、十二烷基硫酸钠、万古霉素更加敏感。有研究报道, ECA合成所必需的wecD和wecA基因突变会导致肠道沙门氏菌对DCA的敏感性提高。ECA缺失导致肠道沙门氏菌DCA耐受能力下降, 提示ECA缺失可能削弱了沙门氏菌细胞膜的结构完整性, 使其对DCA的破坏作用更敏感。肠道沙门氏菌携带的质粒pGE108上的cea::lac融。合基因会被脱氧胆酸钠或牛胆汁提取物激活, 表明肠道沙门氏菌中起DNA修复作用的SOS response(SOS响应)被激活, 意味着胆盐能够引起肠道沙门氏菌DNA损伤。脱氧胆酸盐诱导的SOS响应以经典、依赖于重组酶A(recombinase A, RecA)的方式发生, 只有在存在功能性RecA蛋白时, 脱氧胆酸盐才会诱导SOS响应。同时, 胆汁会增加染色体重排的频率, 同时增加核苷酸替换和移码的频率。脱氧胆酸盐导致的突变谱表明, 暴露于胆汁会诱导肠道沙门氏菌DNA GC碱基对向AT碱基对的转变, 这可能是由胞嘧啶的氧化损伤引起的。此外, 脱氧胆酸钠激活了氧化损伤反应性调节子和超氧化物应激反应调节子的基因转录, 进一步证明脱氧胆酸盐引起的DNA损伤属于氧化性损伤。脱氧胆酸盐降低了肠道沙门氏菌毒力质粒在小鼠回肠中转移频率, 引起毒力质粒的固化, 这是DNA损伤剂的常见特征。 这些工作提供的证据, 表明脱氧胆酸盐会增加核苷酸替换、移码和染色体重排的频率, 支持了脱氧胆酸盐是DNA损伤剂并可能产生双链DNA断裂的观点。
2.大肠杆菌(Escherichia coli)
D′Mello等人利用电子显微镜观察脱氧胆酸盐存在下大肠杆菌的形态, 发现细菌细胞中鞭毛的数量减少, 随着脱氧胆酸盐浓度进一步提高, 鞭毛的形成受到严重抑制。 除了表面形态上的变化, Kandell和Bernstein发现, 在鹅去氧胆酸和脱氧胆酸钠作用下, 大肠 杆菌细胞分裂抑制蛋白(suppressor of lon A, SulA)基因表达增加。 SulA是细菌SOS反应系统的一部分, 其通过抑制细胞分裂蛋白FtsZ环的形成阻止细胞分裂, 是细胞分裂早期阶段的关键步骤。该结果表明SOS反应由胆盐诱导. 作者将他们的结果与SOS反应诱导剂丝裂霉素C(mitomycin C, MMC)处理SOS缺陷细胞的结果进行了比较, 这两项研究都出现相似的结果, 支持胆盐在细菌体内诱导DNA损伤且激活SOS反应的结论。在此基础上, Bernstein等人研究了大肠杆菌对胆盐的应激反应, 发现脱氧胆酸盐、鹅去氧胆酸盐、熊去氧胆酸盐和糖胆酸盐会激活大肠杆菌基因micFosmY和dinD的启动子。dinD由DNA损伤诱导表达, 是SOS反应的一部分, dinD表达的增加表明SOS反应是响应胆盐而引发的一种可能机制。 osmY编码一种功能未知的周质蛋白, 通常参与渗透应激, 而micF是外膜孔蛋白OmpF的负调节因子。osmY和micF基因转录水平的增加表明胆汁可能会引起大肠杆菌DNA的氧化损伤 。 综上, 以上四种胆盐可能会影响大肠杆菌生物膜的组成和功能, 并且在进入细胞后会导致DNA氧化损伤, 并激活SOS反应。 大肠杆菌暴露于天然胆汁酸, 引起特定应激反应基因的表达上调, 可能是对其对胆汁酸导致的膜扰动和DNA氧化损伤的反应。
3.幽门螺杆菌(Helicobacter pylori)
体外试验中幽门螺杆菌的生长被熊去氧胆酸(ursodeoxycholic acid, UDCA)、DCA显著抑制。在最低抑菌浓度下, 扫描电子显微镜观察到幽门螺杆菌的细胞形态由正常的直杆或螺旋杆状转变成球状, 周围出现体积较小的圆球。脱氧胆酸浓度升高后, 幽门螺杆菌细胞进一步降解为球形不规则凝聚块, 具有泡状结构, 其中一些细胞呈现中空的甜甜圈状结构。 幽门螺杆菌细胞的显著形变, 提示DCA可能会破坏幽门螺杆菌的细胞壁或是细胞膜。在另一项胆汁酸影响幽门螺杆菌生长和黏附的实验中, 幽门螺杆菌在麦考伊和胎儿肠道细胞系上的黏附被CDCA抑制, 且在黏附抑制实验中, CDCA的使用浓度仅为抑制其生长最低浓度的十分之一便呈现明显的抑制效果, 这表明CDCA对黏附的抑制作用可能不完全依赖于其对细菌生长的直接抑制。
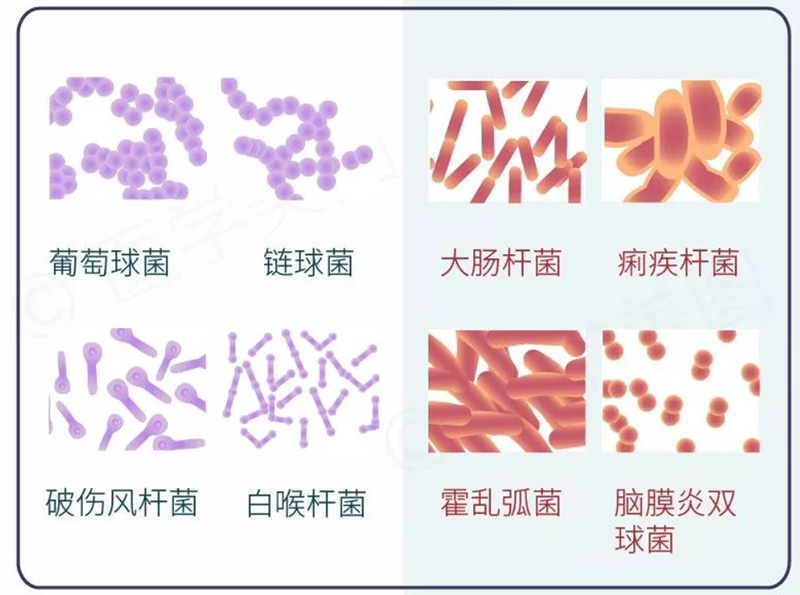
图2.革兰氏阳性菌(左)和革兰氏阴性菌(右)结构特点
4.弯曲杆菌(Campylobacter jejuni)
以鸡为动物模型进行的微生物群移植实验表明, 摄入DCA的鸡肠道中空肠弯曲杆菌定植减少, 这主要是DCA调节鸡的肠道菌群结构, 尤其是对肠道厌氧菌的影响引起 。这种影响可能是诱导肠道厌氧菌的生长, 也有可能是促进厌氧菌产生阻断空肠弯曲杆菌定植的化合物, 因为分别用厌氧菌和需氧菌微生物群对鸡进行一次管饲, 发现厌氧菌显著降低了空肠弯曲杆菌的定植率, 而需氧菌对定植率的影响较小。DCA通过调节肠道厌氧菌生长或胞外代谢物的产生,减少空肠弯曲杆菌在鸡肠道上的定植, 反映了微生物群和微生物代谢物之间独特的双向调节作用。在多药外排泵CmeABC与胆汁抗性的一项研究中, CmeABC通过介导胆汁抗性, 在鸡体内弯曲杆菌的适应中起着关键作用。这一结论有如下证据支持,首先,定点诱变实验表明CmeABC显著提高了弯曲杆菌对多种胆汁盐和洗涤剂的抗性, cmeABC基因突变失活导致在含胆汁盐的培养基和鸡肠提取物中出现生长缺陷,肠道定植实验结果表明cmeABC基因失活消除了弯曲杆菌在鸡体内定植的能力。在使用pCME互补这些突变后, 弯曲杆菌完全恢复了在含胆汁培养基中的生长和在体内的定植能力。这些发现, 加上CmeABC在鸡宿主定植过程中表达的这一事实, 强烈表明胆汁酸抗性对于弯曲杆菌在肠道环境中的成功定植至关重要。8-羟基脱氧鸟苷(8-oxo-deoxyguanosine, 8-oxo-dG)是自由基诱导的氧化损伤的主要形式之一, 已被科学家广泛用作氧化应激的生物标志物。酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)结果显示, 在含脱氧胆酸的培养基中培养的空肠弯曲菌8-oxo-dG水平显著提高, 同时RNA-Seq表明, 起活性氧(reactive oxygen species, ROS)解毒作用的过氧化氢酶的编码基因katA在脱氧胆酸的刺激下被上调, 同时过氧化氢酶活性增加, 这表明脱氧胆酸对空肠弯曲杆菌造成了氧化损伤, 引起细胞内ROS水平升高。已知ROS会导致DNA损伤, 当DNA复制或转录遇到ROS诱导的损伤时,会出现双链断裂. 通过脉冲场凝胶电泳(pulsed field gelelectrophoresis, PFGE)评估了在补充脱氧胆酸的培养基中生长的空肠弯曲菌DNA双链损伤情况, 发现DNA出现片段化, 说明脱氧胆酸引起DNA双链断裂。Svensson等人的研究表明, 0.05% DCA促进弯曲杆菌生物膜形成, 而环境DNA是生物膜形成的必要条件。往培养基中添加环境DNA会促进生物膜形成, 移除培养基中的环境DNA会抑制生物膜的形成,生物膜受损的菌株在静置培养中表现出生长和应激耐受性缺陷, 这表明亚抑菌浓度下的DCA能通过促进生物膜形成来帮助弯曲杆菌来耐受体外不良条件。
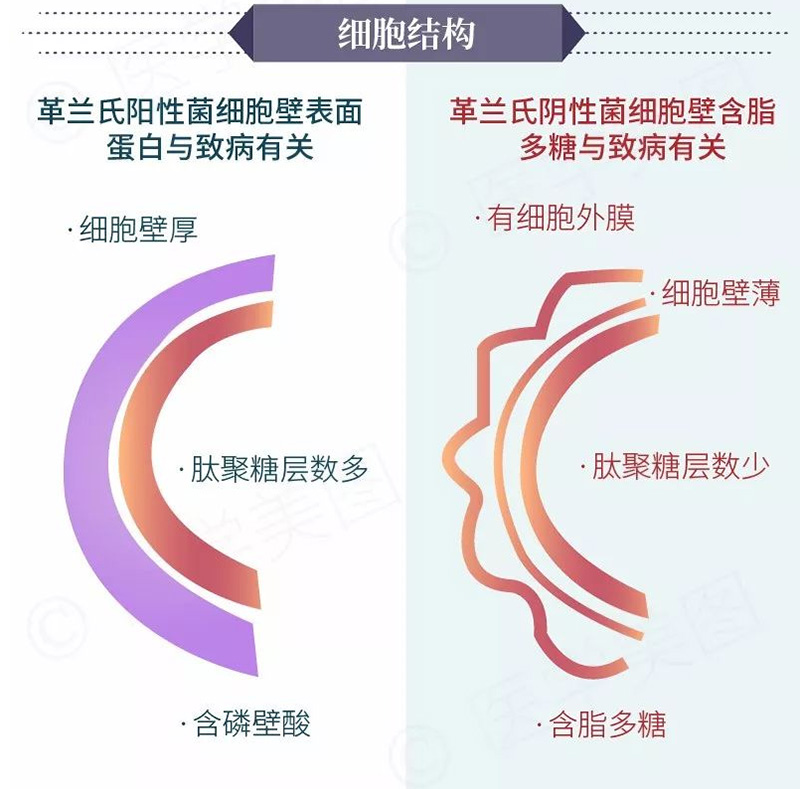
图3.革兰氏阳性菌(左)和革兰氏阴性菌(右)菌种代表
原文:管健,王玉桂,丁昊,等.胆汁酸对肠道微生态的调控研究进展[J/OL].科学通报,1-9[2026-01-07].https://link.cnki.net/urlid/11.1784.N.20251226.0953.008..
备注:转载只为分享,以学习交流为目的,如有侵权,联系删除。