
本文综述了溶血磷脂在健康与疾病中的新兴作用,重点探讨了其生物学功能、代谢机制及相关蛋白的作用,并评估了其在多器官系统中的潜在影响。
1.溶血磷脂酰胆碱
(Lysophosphatidylcholine, LPC)
溶血磷脂酰胆碱(LPC)是血液中最丰富的溶血磷脂,健康个体的血浆中LPC水平可高达150-500μM,在高血脂患者中可达到毫摩尔(mM)水平。LPC可携带饱和或不饱和脂肪酸,主要连接在sn-1位,其浓度是sn-2异构体的九倍。血浆中主要的LPC类型包括LPC16:0、LPC18:1、LPC20:4 和LPC22:6,占总LPC的90%以上。LPC主要来源于肝脏,原代小鼠肝细胞可将 LPC 分泌到培养基中,添加白蛋白可促进其分泌。LPC也可由LCAT(卵磷脂胆固醇酰基转移酶)催化生成,或由PLA1/PLA2水解膜上的PC生成;此外,内皮脂肪酶(EL)也可通过水解HDL中的PC产生LPC。血浆中的 LPC 主要与白蛋白结合,少量存在于脂蛋白、红细胞和血小板中。
溶血磷脂酰胆碱生理作用
发育与功能:LPC被认为是脑生长的重要因子,特别是在脂肪酸递送过程中发挥关键作用。研究表明,MFSD2A(主要促进剂超家族结构域包含蛋白2A)是LPC的关键转运蛋白,负责将必需脂肪酸(如DHA,二十二碳六烯酸)运输到大脑。缺乏MFSD2A会导致脑内必需脂肪酸水平降低,从而影响神经元的膜合成和髓鞘形成。此外,LPC还通过抑制SREBP1/2通路调控新生脂肪酸的合成,表明大脑优先利用LPC携带的必需脂肪酸以支持正常发育。
炎症与免疫调节:LPC具有促炎和抗炎双重作用,其具体效应取决于其生化结构和环境。例如,LPC可以通过诱导细胞黏附分子表达来促进炎症反应。然而,在某些情况下,LPC也可能表现出抗炎特性,例如含有DHA的LPC在sn-1位置时显示出抗炎效果。此外,LPC还能通过G2A受体调节免疫反应。
血管功能与疾病:LPC在血管系统中具有复杂的作用。一方面,它能够通过抑制乙酰胆碱介导的血管舒张而损害主动脉功能。另一方面,LPC还参与了动脉粥样硬化的发病机制,包括单核细胞迁移和细胞因子表达的诱导。此外,高水平的LPC会加剧氧化应激,导致内皮细胞损伤,从而促进心血管疾病的发展。
作为信号分子:LPC不仅是结构脂质,还是一种重要的信号分子。例如,LPC可以激活特定的GPCR(G蛋白偶联受体),如G2A和LPAR1,从而调节细胞行为。此外,LPC还可能通过其他未知受体参与钙信号传导。
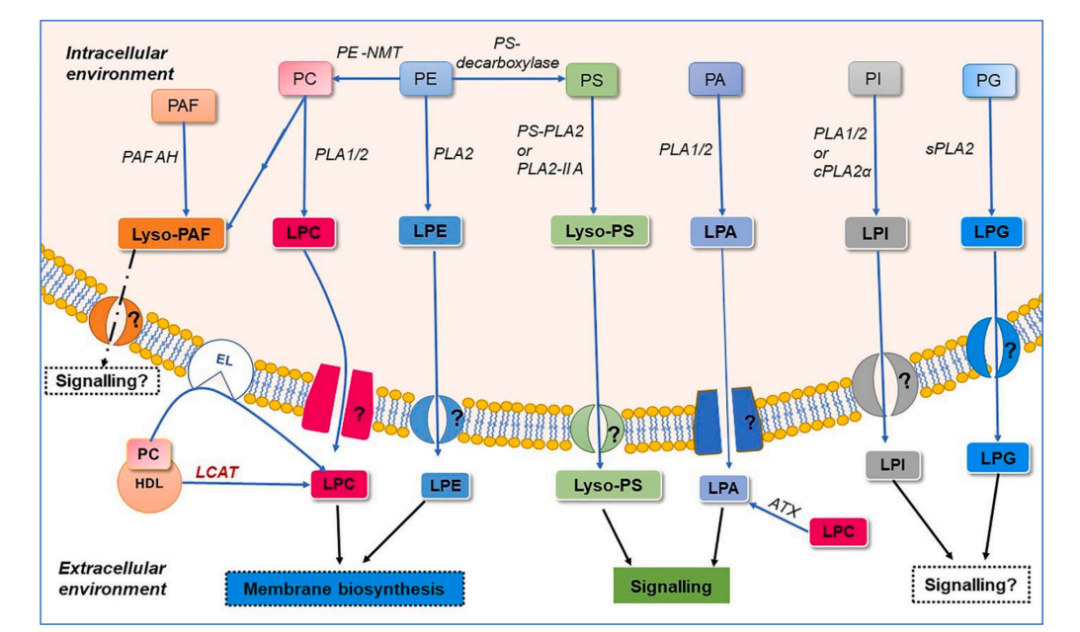
图1.溶血磷脂合成途径图示
2.溶血磷脂酰乙醇胺(Lysophosphatidylethanolamine, LPE)
溶血磷脂酰乙醇胺(LPE)可以通过磷脂酶PLA2作用于细胞膜上的磷脂酰乙醇胺生成。在血液中,LPE是第二丰富的溶血磷脂,浓度范围为10到50μM,约占总血清磷脂的1%。LPE种类包括短链到长链脂肪酸。像LPC一样,白蛋白也是LPE在血液中的载体,但产生循环LPE的细胞类型和组织仍然未被表征。
溶血磷脂酰乙醇胺生理作用
作为信号分子:LPE能够通过特定的受体或信号通路调节细胞功能。例如,研究表明LPE可能通过G蛋白偶联受体(如LPA1)激活下游信号通路,导致细胞内钙离子浓度增加和磷脂酶C(PLC)的活化。这种信号传导机制表明LPE在调控细胞行为中可能具有重要作用。
促进细胞迁移和血管生成:LPE被发现能够诱导人脐静脉内皮细胞(HUVEC)的趋化迁移和管状结构形成,这表明LPE在调节内皮细胞活性方面具有显著作用。这些特性可能与血管生成和组织修复相关,提示LPE在伤口愈合和血管发育中的潜在功能。
免疫调节作用:尽管具体机制尚不完全清楚,但LPE可能参与免疫调节过程。例如,某些研究指出LPE可以通过激活特定受体(如LPA1或CD97)影响癌细胞的迁移和侵袭能力。此外,LPE还可能通过调节炎症因子的释放参与免疫反应。
神经保护和神经活性作用:LPE在神经系统中也可能发挥重要作用。例如,Grifola frondosa(一种食用菌)中的LPE被证明能够通过激活MAPK信号通路表现出神经营养活性。这表明LPE可能在神经保护或神经再生中具有潜在应用价值。
与其他生物分子的协同作用:LPE通常与其他溶血磷脂(如LPC、LPA)共同存在于血液中,并可能通过协同作用调节多种生理过程。例如,LPE与白蛋白结合后能够在血液中稳定存在,并可能通过这种方式调节其生物利用度。
3.溶血磷脂酸
(Lysophosphatidic acid, LPA)
溶血磷脂酸(LPA)是最简单的溶血磷脂形式,血浆中浓度范围为0.1-1μM,血清中可达5-10μM。LPA物种包括LPA16:0、LPA18:0、LPA18:1、LPA18:2、LPA20:4和LPA22:6。这些LPA物种可以通过两条主要途径合成。首先,在血小板和血浆中,溶血磷脂如LPC、Lyso-PS和LPE可以通过自分泌素(ATX,基因名为ENPP2)转化为LPA。其次,通过磷脂酶D或二酰甘油激酶从磷脂生成的磷脂酸(PA),可以直接通过PLA1或PLA2的作用转化为LPA。
溶血磷脂酸生理作用
分泌型PLA2-IIA(SPLA2-IIA),最初被提出是一种源自肝细胞的急性期蛋白,其在免疫防御中发挥作用,其通过与血浆膜表面上的PC结合的能力,能够水解细胞膜,从而产生比任何其他类型的PLA2更强的杀菌效果。sPLA2-IlA特别是在病理生理条件下,诱导血小板来源的细胞外囊泡释放LPA。这种酶通常在各种细胞受到促炎细胞因子的刺激时释放,并在炎症部位积累,它能够选择性地水解从Ca2+负载的红细胞和激活的血小板释放的微囊表面暴露的磷脂酸。因此,血浆中sPLA2-IIA的高浓度是炎症性疾病中观察到的关键标志物。尽管sPLA2-IIA仅对分泌的LPA占很小比例,但它可能是某些微环境中LPA积累的重要来源,特别是在炎症部位。
循环LPA的生理作用是通过刺激LPA受体来诱导信号传递。目前已知有六种LPA受体(LPAR1-6),它们具有不同且部分重叠的功能。前三种LPA受体,即LPAR1-3,被归类为内皮细胞分化基因(EDG)家族;EDG2/LPAR1、EDG4/LPAR2和EDG7/LPAR3,这些受体在组织中的分布有所不同。LPAR4-6属于非EDG纯化基因家族,与LPAR1-3在系统发育上更为远亲。作为LPC水解过程中主要的LPA生成酶,ATX的功能与LPA的信号作紧密相关。
4.溶血磷脂酰肌醇
(Lysophosphatidylinositol LPI)
LPI是一种溶血甘油磷脂,其头部基团为肌醇。LPI主要通过磷脂酶PLA1和PLA2的作用生成,这些酶分别从甘油磷脂的sn-1和sn-2位置去除脂肪酸。在人体血浆中,LPI通常以低浓度(<0.1μM)存在,但在某些病理条件下中,其水平显著升高至约15μM。此外,肥胖个体中也检测到高水平的LPI,这表明其可能与肥胖相关的代谢过程有关。
溶血磷脂酰肌醇生理作用
LPI的生理功能与其在调节脂质储存和脂肪细胞分化中的作用密切相关。研究表明,LPI通过上调脂质生成基因来促进脂质储存,并推动前脂肪细胞向成熟脂肪细胞的分化,从而与肥胖的发生机制相关联。此外,LPI的具体受体尚未完全明确,但已有研究提示其可能通过特定信号通路参与调控细胞活动。在胰岛中刺激胰岛素分泌,与胰岛素协同促进细胞增殖。
编译:伏晓晓
原文:Tan S T, Ramesh T, Toh X R, et al. Emerging roles of lysophospholipids in health and disease[J]. Progress in Lipid Research, 2020, 80: 101068.
备注:转载只为分享,仅供学习交流为目的,如有侵权,联系删除。