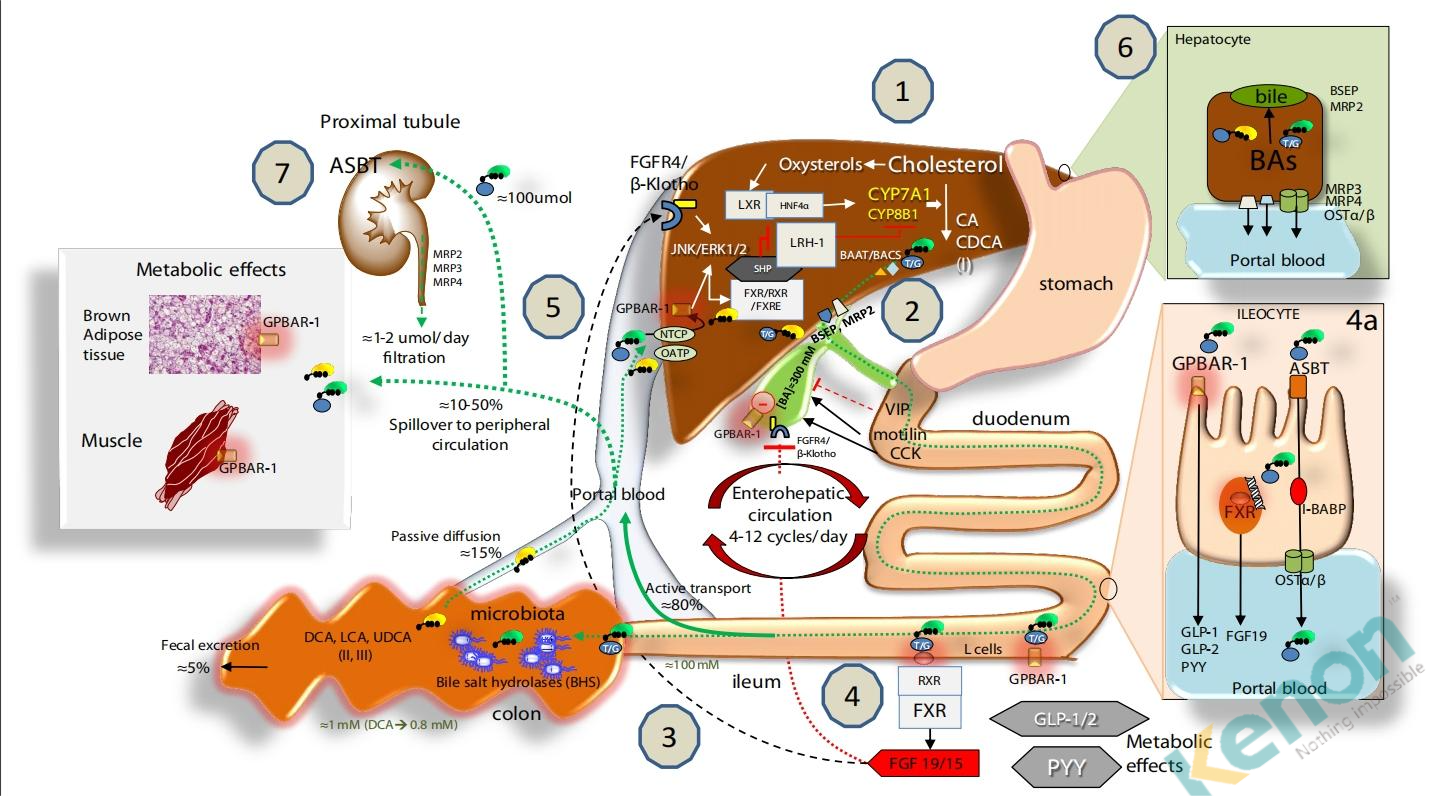
Agostino Di Ciaula;2017
法尼醇X受体(FXR):FXR是核受体家族成员,主要参与胆汁酸代谢和脂质调节。
维甲酸X受体(RXR):类视黄醇X受体,可与多种配体结合,激活后影响特定基因的转录,进而对细胞的生长、分化以及脂质、糖代谢等发挥重要的调控作用,比如在脂肪细胞分化、血脂调节等诸多方面都起着关键作用。
小异二聚体伴侣(SHP):SHP是一种孤儿核受体,通过与其他受体(如LRH-1)形成异二聚体发挥抑制作用。
肝脏受体同源物-1(LRH-1):属于核受体超家族,与类固醇生成因子1(SF-1)高度同源。
肝脏X受体(LXR):LXR主要参与胆固醇代谢和炎症反应调控。
1.在肝脏中,BAs主要由胆固醇通过限速酶7α-羟化酶(CYP7A1)和CYP8B1经“经典途径”合成,以及通过CYP27A1经“替代途径”合成。BA主要通过两种酶与牛磺酸或甘氨酸结合,这两种酶是BA辅酶A合成酶(BACS)和BA辅酶A-氨基酸N-乙酰转移酶(BAAT),它们由胆盐外排泵(BSEP)分泌到胆汁中;多药耐药相关蛋白(MRP2)介导有机底物如胆红素和谷胱甘肽的分泌。
2.在胆囊中,由于水分吸收,胆汁被浓缩和储存,在进食之后由于肠激素胆囊收缩素CCK8的作用定期释放到十二指肠。这种节律活动还与胆囊放松/再充盈同步调节,这归因于血管肠肽(VIP,由胃酸在十二指肠释放)、胆汁酸本身(作用于胆囊受体GPBAR-1)以及肠道FGF15/19(在回肠中胆汁酸与FXR相互作用后)对FGF4/β-Klotho受体的作用,该受体也在胆囊中表达。健康受试者的空腹血清胆汁酸浓度为0.2-0.7µM,在每餐后增加到4-5µM。
3.胆汁酸在回肠末端被高效(>95%)重吸收。胆汁酸进入结肠,经肠道微生物群生物转化生成次级胆汁酸,并通过被动扩散和重吸收过程。每天只有5%的胆汁酸以粪便形式排出体外。胆汁酸的肝肠循环包括其在肠道中的重吸收以及通过门静脉持续回流至肝脏的过程。大约10-50%的重吸收胆汁酸会溢出到外周系统循环中。
4.到达回肠后,胆汁酸激活FXR并增加肠激酶纤维母细胞生长因子19(人类为FGF19或小鼠为FGF15)的转录,该因子进入门静脉循环,调节胆囊(2)和肝脏效应(5)。肠道中的胆汁酸还激活G蛋白偶联受体(GPBAR-1),刺激肽YY(PYY)、胰高血糖素样肽1(GLP-1)和胰高血糖素样肽2(GLP-2)的分泌,这些物质对葡萄糖代谢、胰岛素代谢和食欲产生重要影响,作用于位于棕色脂肪组织和肌肉细胞中的GPBAR-1受体。在回肠细胞中,胆汁酸的摄取、胞内运输和分泌到门静脉分别需要顶端钠依赖性胆汁酸转运蛋白(ASBT)、细胞内胆汁酸结合蛋白(I-BABP)和基底外侧异二聚有机溶质转运蛋白(OSTα/β)(4a)。
5.循环中的FGF19与肝脏FGF受体4(FGFR4)/β-结节蛋白结合,激活c-Jun氨基末端激酶/细胞外信号调节激酶(JNK/ERK)信号通路,该通路协同FXR-SHP抑制途径,抑制CYP7A1和CYP8B1的表达及肝脏BA合成。肝脏通过钠胆酸共转运多肽(NTCP)和有机阴离子转运多肽(OATP)转运蛋白进入肝脏,作为生理核配体与FXR结合,通过与RXRs形成异二聚体来调控靶基因转录。这导致小异二聚体伴侣(SHP)表达的转录增加。SHP继而抑制LRH-1,阻止参与胆汁酸和脂肪酸合成的目标基因被激活。在没有胆汁酸的情况下,LRH-1与LXR共同作用,刺激胆汁酸的合成。FXR还调节参与胆汁酸与甘氨酸或牛磺酸结合以及肝脏胆汁酸分泌的酶活性,包括BSEP和ABCB4介导的肝磷脂分泌。重新进入肝脏的胆汁酸还会与库普弗细胞中表达的肝GPBAR-1相互作用,协同FGFR4/β-Klotho激活的途径。FXR的激活还协调胆汁酸解毒酶(如胞质硫酸转移酶2A1 [SULT2A1]、醛酮还原酶1 B7 [AKR1B7]、细胞色素P450 3A4/3a11 [CYP3A4/ Cyp3a11]和UDP-糖基转移酶2B4 [UTG2B4])的活性。
6.胆汁酸从肝细胞排入门静脉的过程:特定转运蛋白包括多药耐药蛋白3和4(MRP3、MRP4)以及OSTα/β。
7.从外周循环中,BAs还通过近端小管顶端钠依赖性胆汁酸转运蛋白(ASBT)进入肾脏。BAs的肾小球滤过受MRP2、3、4转运蛋白的调节。