膳食油脂是人体摄入的重要营养成分,主要由甘油三酯(triglycerides)、磷脂(phospholipids)、胆固醇(cholesterol)、脂溶性维生素等构成。作为人体不可缺少的一类营养素,其代谢和吸收在营养学领域中占据重要地位。它们在提供能量、构建细胞膜以及维持体内多种生理功能中扮演关键角色。然而,由于油脂不溶于水,其消化和吸收过程相对复杂,需要经历乳化、酶解、转运、细胞内代谢及转运至体循环等多个生理步骤。以下将详细解析膳食油脂在肠道中的消化吸收过程。
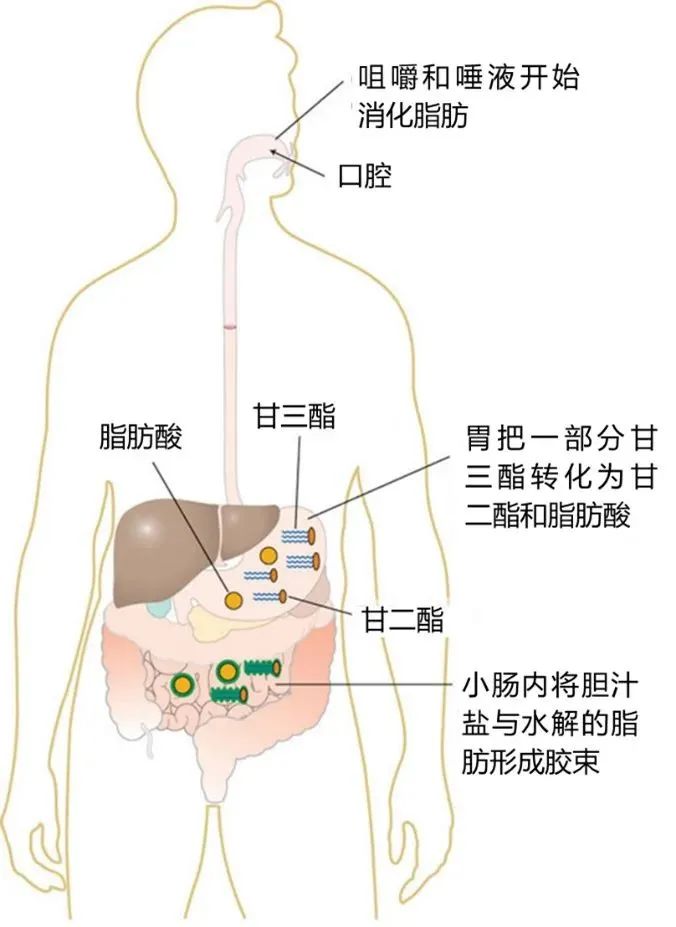
膳食油脂在肠道中消化吸收过程示意图
1. 膳食油脂在胃肠道的消化
膳食油脂的消化分为口腔消化、胃消化和小肠消化过程,舌脂肪酶及胃脂肪酶可以水解短链甘油三脂,随后进入小肠后,通过小肠蠕动,在胆汁中的胆汁酸盐的作用下使油脂发生乳化作用。胆汁酸是两性分子,一端亲水、一端疏水,它们能够将不溶于水的脂肪大颗粒分解为更小的脂肪滴,从而增加脂质与消化酶的接触表面积,有利于脂类的消化与吸收。乳化完成后,胰脂肪酶(pancreatic lipase)与其他辅助因子如共脂肪酶相互作用,水解甘油三酯,将其分解为2-单酰甘油(2-monoglycerides)和游离脂肪酸(free fatty acids),这些脂质产物能够被肠道上皮细胞吸收。此外,胆固醇酯和磷脂分别在胆固醇酯酶和磷脂酶A2的作用下被水解为游离胆固醇和溶血磷脂,从而准备进入吸收阶段。
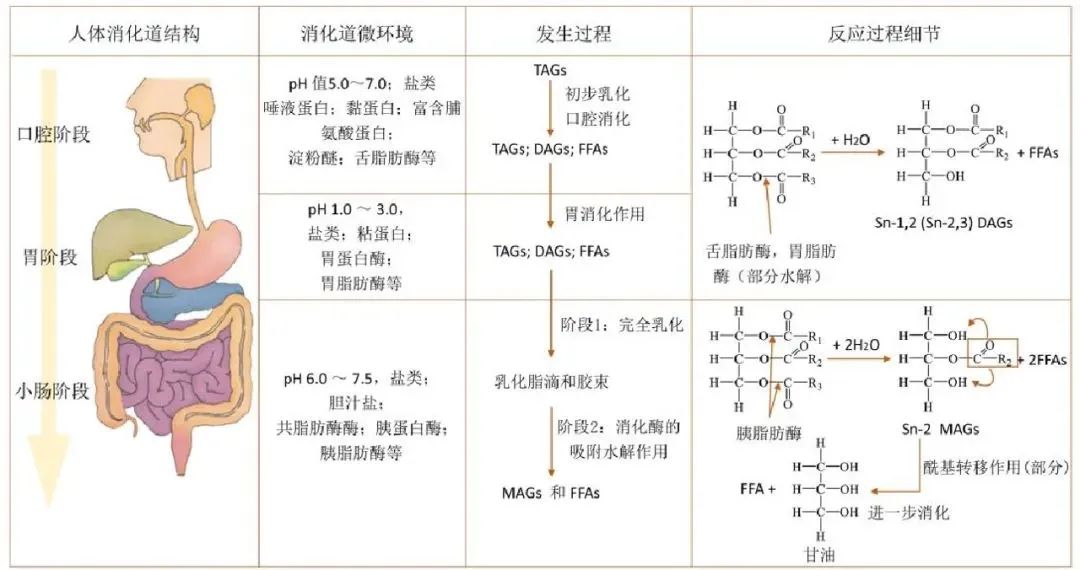
人体消化结构与膳食油脂在胃肠道中的消化过程
2. 膳食油脂在小肠中的吸收
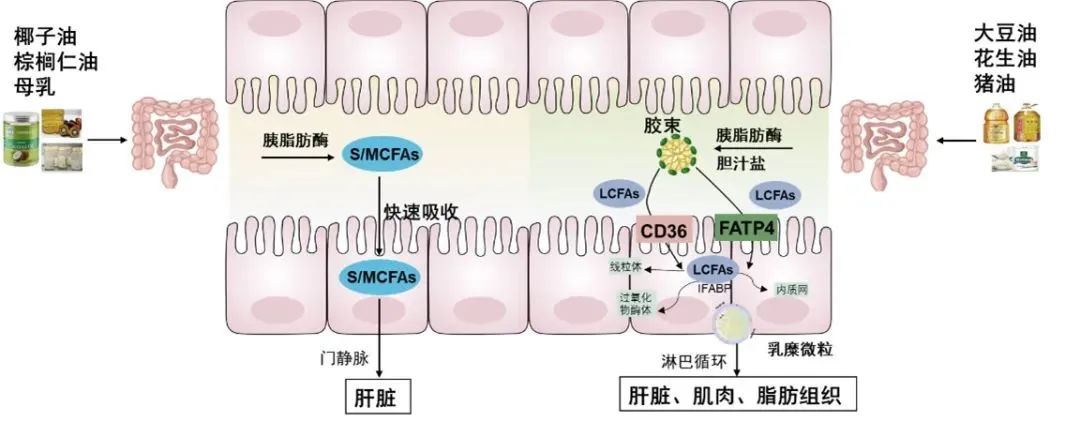
乳化后的脂质产物与胆汁酸形成混合胶束(mixed micelles),这类结构可以使脂解产物在肠道水溶性环境中保持稳定,且体积很小,极性较强。这些混合胶束将脂解产物传递至小肠上皮细胞的微绒毛表面,脂解后的产物通过被动扩散或蛋白质介导的方式进入小肠上皮细胞而被吸收。具体吸收机制根据脂质产物类型(如SCFA,MSCFA,LCPF和MAG)而有所不同。
2.1 短链和中链脂肪酸的吸收
短链脂肪酸(SCFA)和中链脂肪酸(MCFA)由于分子较小,水溶性较强,能够通过被动扩散直接穿过小肠上皮细胞膜进入细胞。这些脂肪酸无需复杂的转运过程,直接进入门静脉系统并运送至肝脏进行代谢。此过程相对简单,吸收效率较高。短、中链脂肪酸构成的甘油三脂经胆盐乳化后在肠黏膜细胞内脂肪酶作用下水解成脂肪酸及甘油,通过门静脉进入血循环。
2.2 长链脂肪酸的吸收
长链脂肪酸(LCFA)跨越细胞质膜的机制多年来一直存在争议,核心问题在于这一过程是通过被动扩散发生还是由蛋白质介导的。早期研究认为,肠细胞对脂肪酸的摄取是通过被动扩散过程实现的,不依赖于蛋白质介导,只是浓度差异的自然扩散。然而,仅仅依赖于浓度梯度的被动扩散机制无法充分解释一些现象,如脂肪酸摄取过程中的细胞特异性、高亲和力以及对不同脂肪酸的选择性。实际上,脂肪酸摄取的特异性与高亲和力是依赖于转运蛋白的协同作用。(1)CD36转运蛋白:CD36是长链脂肪酸摄取的关键转运蛋白之一,位于小肠近端肠上皮的刷状边缘处。CD36具有疏水性口袋结构,这使它能够与LCFA结合,通过将脂肪酸导向细胞膜的外瓣叶(即细胞膜的外层),并在那里将其吸附到细胞膜表面。在CD36的作用下,结合的长链脂肪酸发生易位或翻转,穿过细胞膜。一旦脂肪酸穿过细胞膜,它会与位于CD36胞内区域的脂肪酸结合蛋白(FABP)结合,FABP蛋白负责将LCFA转运至细胞内部的不同代谢部位,比如线粒体、内质网、过氧化物酶体等,确保脂肪酸的高效再利用。(2)脂肪酸转运蛋白4(FATP4):FATP4位于肠细胞膜上,可以直接与LCFA结合并将其转运入细胞内。除了转运脂肪酸外,FATP家族成员还具有酰基辅酶A合成酶的活性,能够将进入细胞的LCFA快速转化为脂酰辅酶A(acyl-CoA),从而锁定脂肪酸在细胞内。FATP4是长链和超长链脂肪酸转运的关键蛋白,可能的机制是通过FATP4将LCFA带到细胞膜上,并降低LCPF跨膜的能量障碍,从而促进LCPF的扩散。(3)肠型脂肪酸结合蛋白(IFABP):一旦长链脂肪酸进入肠上皮细胞,它们与细胞内的IFABP结合,转运至内质网等代谢部位,确保脂肪酸的高效再利用。
2.3 单甘脂的吸收
单甘脂(MAG)与长链脂肪酸类似,形成混合微胶束后运送至肠上皮细胞膜,可以通过简单扩散和部分脂质转运蛋白(如CD36和FATP4)辅助进入肠细胞。进入细胞后,MAG会在内质网中与LCFA再酯化生成甘油三酯(TAG),新合成的TAG一部分会转移至细胞质参与细胞质脂滴的合成存储能量,部分会形成乳糜颗粒,运输至淋巴系统参与体循环。
2.4 胆固醇的吸收
胆固醇的吸收主要在小肠上皮细胞中进行,由胆固醇转运蛋白 (NPC1L1) 介导的。NPC1L1分布在小肠刷状缘膜上,能高效地结合膳食胆固醇和胆汁中回收的胆固醇分子,将其从小肠腔内转运至肠细胞内,这一过程是胆固醇吸收的关键步骤。胆固醇进入肠细胞后,可以被内质网中的乙酰辅酶A胆固醇酰基转移酶(ACAT)催化,生成胆固醇酯,使其更易于包装到脂蛋白中。胆固醇酯主要会进入乳糜颗粒(CM),这些颗粒负责将膳食脂质从肠道运输到淋巴系统,再进入血液循环。未酯化的胆固醇不会转化为胆固醇酯,而是可以直接被整合到高密度脂蛋白(HDL)颗粒中,从而进入血液循环。
2.5磷脂的吸收
磷脂是膳食和胆汁中的重要成分,可以通过简单扩散的方式直接穿过肠细胞膜进入细胞。研究表明,ATP结合盒转运蛋白B4(ABCB4)可能在磷脂的跨膜运输中发挥作用,但具体机制尚未完全明确。磷脂进入肠细胞后,磷脂可能与脂肪酸结合,形成新的磷脂分子,进一步进入内质网合成其他更复杂的脂类,如磷脂酰胆碱、磷脂酰乙醇胺等。吸收的磷脂部分会加入乳糜颗粒,通过淋巴系统运输到血液;另一部分则可以直接形成高密度脂蛋白(HDL)颗粒并进入血液。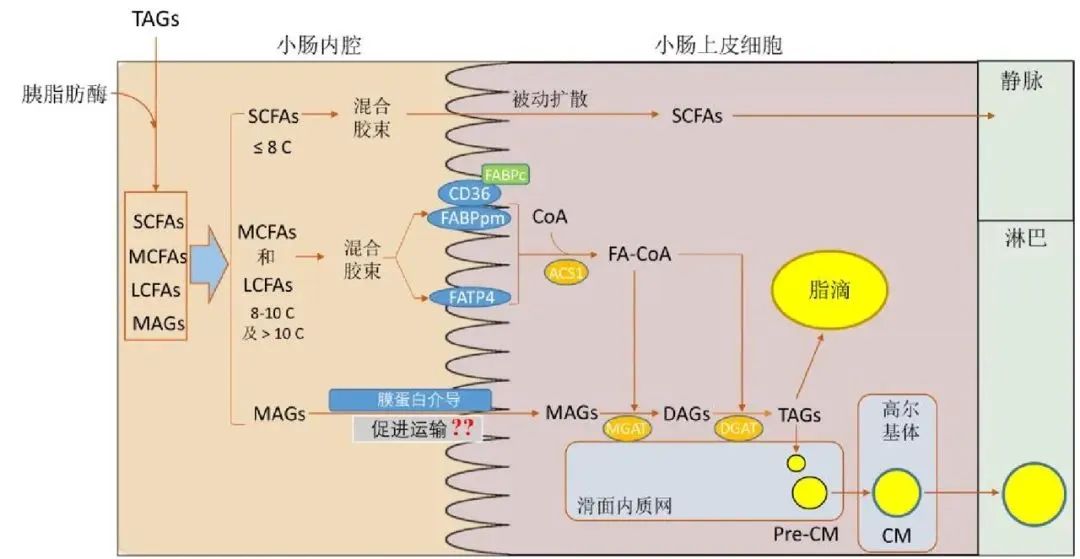
膳食油脂在肠道吸收过程中的分子机制
3. 脂肪酸的代谢与乳糜微粒的形成
膳食中的脂肪酸首先被乳化并形成微胶束,脂肪酸从这些微胶束中释放出来,通过脂质膜进入肠上皮细胞内,进入肠上皮细胞的长链脂肪酸在内质网(endoplasmic reticulum, ER)中重新合成为甘油三酯。这一过程由一系列酶催化完成的,特别是甘油三酯合成酶在脂肪酸与甘油分子的重构中起关键作用。除甘油三酯外,吸收入细胞的游离胆固醇和磷脂也在肠细胞内进行重新合成,形成细胞所需的脂类。这些重新合成的脂质分子(如甘油三脂、胆固醇和磷脂)会与特定的蛋白质结合,形成乳糜微粒(chylomicrons)。乳糜微粒是一种包含甘油三酯、胆固醇、磷脂和脂溶性维生素的脂质运输颗粒,外层由磷脂和蛋白质形成的单层膜包裹,能够在水溶性血浆中稳定存在。乳糜微粒再通过胞吐作用(exocytosis)被释放到肠上皮细胞的细胞间隙,随后进入淋巴系统。
4. 乳糜微粒的转运与脂肪酸的全身分布
乳糜微粒进入淋巴系统后,经过胸导管进入血液循环,逐渐被身体各个组织器官摄取和利用,特别是肝脏、肌肉和脂肪组织。在这些组织中,乳糜微粒中的脂质被代谢,提供细胞所需的能量,同时也是储存脂质的重要形式。
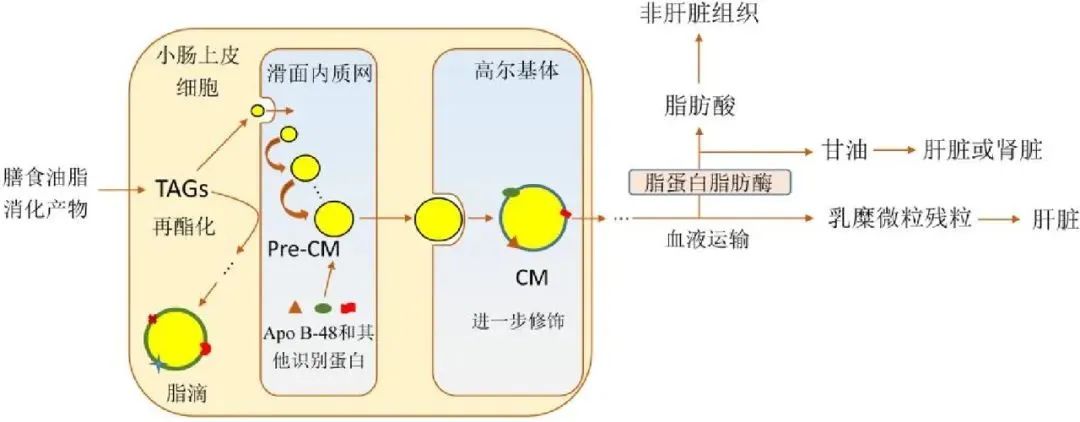
膳食油脂消化后的转运及代谢过程
5. 油脂吸收的调控机制与影响因素
膳食油脂的吸收不仅依赖于消化系统的生理功能,还受到多种内外因素的调节。
5.1 胆汁酸的回收与脂肪酸吸收
胆汁酸在油脂吸收过程中发挥重要作用,其有效回收是保障脂肪酸高效吸收的关键。胆汁酸在回肠末端被重吸收,经过肝肠循环返回肝脏并重新分泌到胆囊,从而维持其在消化道中的稳定浓度。
5.2 激素的调控作用
胰岛素、胰高血糖素样肽-1(GLP-1)等胃肠激素在餐后分泌,作用于肠道上皮细胞和转运蛋白,调节脂肪酸的吸收和代谢。此外,胰岛素还调控脂肪酸的细胞内代谢,促进脂肪酸向脂肪组织储存。
5.3 营养和膳食因素
膳食中的纤维、蛋白质、碳水化合物及其他微量营养素对脂肪酸的吸收有直接影响。例如,高膳食纤维可能通过增加肠内容物的黏度,减少脂肪酸与小肠上皮的接触,从而降低脂肪酸的吸收率。此外,膳食中多不饱和脂肪酸的比例也会影响脂肪酸吸收的效率。
5.4 病理状态对脂肪酸吸收的影响
某些疾病状态可能影响脂肪酸的正常吸收,如胰腺功能不全、胆汁酸代谢障碍或小肠吸收不良综合征。这些疾病通过干扰乳化、脂解或转运过程,导致脂肪酸吸收障碍,进而影响全身的能量代谢。
6. 结论
脂肪酸的吸收是膳食油脂代谢中至关重要的环节,涉及多个复杂的生理过程和分子机制。油脂在肠道中经历乳化、脂解、转运和再合成等步骤,最终以乳糜微粒的形式进入淋巴系统,并通过血液循环输送至全身各组织。脂肪酸的吸收过程受胆汁酸、转运蛋白和激素等多重因素的调控,而其吸收效率则受到膳食组成、病理状态等因素的影响。
参考文献:
[1] Mansbach CM 2nd, Nevin P. Intracellular movement of triacylglycerols in the intestine[J]. J Lipid Res, 1998, 39(5):963-968.
[2] Mu H, Høy CE. The digestion of dietary triacylglycerols[J]. Prog Lipid Res, 2004, 43(2):105-133.
[3] Ko CW, Qu J, Black DD, et al. Regulation of intestinal lipid metabolism: current concepts and relevance to disease[J]. Nat Rev Gastroenterol Hepatol, 2020, 17(3):169-183.
[4] Xiao C, Stahel P, Lewis GF. Regulation of chylomicron secretion: Focus on post-assembly mechanisms[J]. Cell Mol Gastroenterol Hepatol, 2019, 7(3):487-501.
[5] 叶展. 典型膳食油脂胃肠道消化吸收特性及其对肠道健康的影响研究[D]. 江南大学, 2020.
注:文章内容来自脂质江南,文章转载仅供大家学习、交流,如有版权问题请联系作者删除。